帕金森病模型思考
传统的帕金森模型认为,运动中具有相反作用的两条神经通路的活动水平在疾病中活化程度不平衡。而对小鼠的分析结果得出了一个更为复杂的事实。
>>>>基底神经节与运动控制及运动障碍疾病
科学家们认为: 前脑中称为基底神经节的相关结构与运动的控制以及运动障碍(如帕金森病)相关。一些基底神经节在运动中起作用的有力证据来自于解剖学1:基底神经节通过纹状体区域接收来自大脑额叶皮层的运动相关区域的神经元信号输入,然后再将其送回额叶皮质。上述处理过程由两个途径介导,但两个途径如何导致运动障的解释上仍存在争议。而Parker 2等人在《自然》杂志上发表的一篇论文中,为解释这一争议添加了宝贵的数据。
>>>>传统基底神经节模型
在传统的基底神经节功能模型中,纹状体连接到输出结构的两条途径以相反的方式工作。第一条途径被称为直接通路,由神经递质分子多巴胺通过直接通路棘突投射神经元(DPNs)上的D1样多巴胺受体激活,激活DSPNs有利于运动1,3,4。第二条途径,间接通路,多巴胺通过间接途径棘突投射神经元(ISPNs)D2样受体抑制。与第一条通路相反,ISPNs的激活被认为可以降低运动功能1,3,4。
然而当前的基底神经节功能模型强调,这两种途径的平衡是正常运动所必需的。例如,假定一个模型按顺序激活这两条途径可以测量运动功能-首先,激活DSPNs将促进运动,随后激活ISPN将终止运动5。或者,动作选择假说认为,DSPN和ISPN之间的相互作用可能有助于选择额叶皮层的特定动作,并启动与DSPN激活相关的某些运动,以及与ISPN激活相关联的运动预防6,7。
这些模型预测运动障碍是由不平衡的通路激活引起的。例如,传统上有争议的是1,在帕金森疾病中(涉及降低纹状体多巴胺水平),平衡将有利于ISPN激活,导致缓慢或缺乏运动。与此相反,非自主运动(运动障碍),如与过度使用抗帕金森药物L-3,4-二羟基苯丙氨酸(L-DOPA)有关,会引发机体从ISPN激活向DSPN激活转变(图1A)。
>>>>Paker’s模型
Parker等人使用一种称为荧光显微内窥镜的方法8 - 10,同时监测自由行动小鼠中DSPN和ISPN的活性和空间排列。当钙进入细胞时,这两组神经元通过基因工程方法被标记荧光,表明电信号产生。作者分别对三组小鼠进行了监测:正常情况下,通过药物干预小鼠引起释放多巴胺神经元丢失来模拟帕金森疾病状态,接着使用左旋多巴对多巴胺缺乏的治疗,引起不自主运动。
作者在正常动物中观察到9-13,相似大小的ISPNs和DSPNs群在运动过程中同时被激活。这些数据与测量模型(DSPN在ISPN之前活动)和动作选择模型(预测抑制运动功能的ISPN簇应该大于促进运动功能的DSPN簇)相矛盾。相反,他们增加了的许多证据表明,这两个通路可能不调节运动的基本执行过程,可能会在高级行为活动中发挥作用,例如通过强化学习14或控制运动的“活力”15调节运动的动态形成。
当作者研究多巴胺缺失的帕金森疾病动物模型时,如常规动物模型实验结果所预测的,他们发现DSPN活性降低和ISPN活性增加。然而,他们也发现运动相关的ISPNs激活随着时间的推移而下降,并且在它们激活的空间聚类中下降(图1B)。
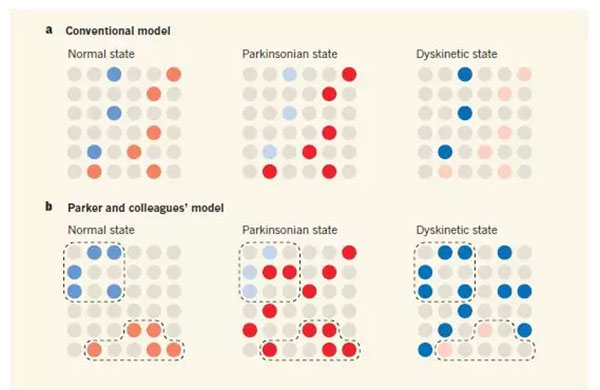
图1大脑纹状体中运动相关的神经元激活模型。(蓝色圆圈代表DSPN激活,颜色越深表示激活程度越高;红色圆圈代表ISPN激活;灰色圆圈代表两种神经元均未激活;)
正如预期的那样,激活D1样受体的药物增加帕金森病小鼠的DSPN活性,而刺激D2样受体的药物降低了升高的ISPN激活率。L-DOPA治疗是目前唯一的治疗药物,激活两种受体,引起两种效应,逆转了ISPN在聚类中的缺失,也许正解释了其优越的临床疗效。最后,这些有益的作用在L-DOPA诱发的非自主运动的动物模型中被夸大,ISPNs活跃度低,DSPN 活跃度高和较少聚集。
因此,Parker和同事的研究支持了早期工作中关于正常、帕金森和运动障碍状态的活动变化的许多一般性结论。然而,这也表明,传统模型过于简化,因为他们不能解释新发现的活化的纹状体神经元在疾病状态中的空间聚集性变化。
这项研究很好地让我们了解到在过去的几年中,科学家对基底神经节环路的认识到底有多深入。过去,我们只可以记录一个单一的,未识别的纹状体神经元,现在我们可以同时监测数百个具有遗传特征的神经元,尽管仍具有时间分辨率较低,植入微内窥镜会造成组织损伤等缺点。但是正如Parker和同事们所展示的,这些技术可以洞察用传统方法无法研究的疾病机制。本研究所提供的结果表明,它可能是值得开发的治疗策略。在其他部分的基底神经节,已经使用药理学技术16和深部脑刺激技术17,18在进行类似的探索。
和任何好的研究一样,这项研究引出更多的问题需要回答,特别是关于作者所见到的活化神经元空间聚类的变化。例如,在帕金森病和运动障碍状态下的聚类异常的机制尚不清楚,它们是否反映纹状体的输入变化或真正的纹状体现象尚不清楚。也不清楚是否在人类或其他灵长类动物中发生类似的聚集,或是否伴随着其他基底节结构中神经元活动的改变聚类。
最后,一个最重要的问题是观察到的基底神经节中神经元活化的空间和时间聚类的变化是否与帕金森病或运动障碍的发展有因果关系。不管答案如何,Parker和同事们的研究使得我们从一个新的维度上认识这种疾病。
>>>>参考文献
1. DeLong, M. R. Trends Neurosci. 13, 281–285(1990).
2. Parker, J. G. et al. Nature 557, 177–182(2018).
3. Kravitz, A. V. et al. Nature 466, 622–626(2010).
4. Freeze, B. S., Kravitz, A. V.,Hammack, N., Berke, J. D. & Kreitzer, A. C. J. Neurosci. 33, 18531–18539(2013).
5. DeLong, M. & Wichmann, T. Clin. EEG Neurosci. 41, 61–67 (2010).
6. Mink, J. W. Prog. Neurobiol. 50, 381–425(1996).
7. Nambu, A. Curr. Opin. Neurobiol. 18,595–604 (2008).
8. Bocarsly, M. E. et al. Biomed. Opt. Express 6, 4546–4556 (2015).
9. Klaus, A. et al. Neuron 95, 1171–1180(2017).
10. Barbera, G. et al. Neuron 92, 202–213(2016).
11. Tecuapetla, F., Matias, S., Dugue,G. P., Mainen, Z. F. & Costa, R. M. NatureCommun. 5, 4315 (2014).
12. Tecuapetla, F., Jin, X., Lima, S.Q. & Costa, R. M. Cell 166, 703–715 (2016).
13. Cui, G. et al. Nature 494, 238–242(2013).
14. Hikosaka, O., Kim, H. F., Yasuda,M. & Yamamoto, S. Annu. Rev.Neurosci. 37, 289–306 (2014).
15. Turner, R. S. & Desmurget, M. Curr. Opin. Neurobiol. 20, 704–716 (2010).
16. McIver, E., Atherton, J.,Surmeier, D. & Bevan, M. D. in Neuroscience2015 abstr. 708.711 (Soc. Neurosci., 2015).
17. Wang, J. et al. Brain Stimul. 9, 609–617 (2016).
18.Adamchic, I. et al. Mov. Disord. 29, 1679–1684 (2014).
上一篇: 人造神经元的计算速度比人脑更快
下一篇: 脊柱注射软骨素酶ABC可促进脑卒中恢复









